
我国3D打印髋臼杯植入物产品注册技术审查指导原则征求意见稿已宣布
宣布时间:
2023-01-11 12:45
3D打印髋臼杯是我国最早获得医疗器械注册证的金属3D打印植入物产品
。凭据3D科学谷的市场研究,目前我国已有两款通过国家药品监督治理局(NMPA)审批,获得医疗器械注册证的国产化3D打印髋臼杯产品,包括:北京爱康宜诚医疗器材股份有限公司的“髋枢纽假体 髋臼部件”以及嘉思特华剑医疗器材(天津)有限公司生产的包括髋臼杯部件的“骨小梁髋枢纽假体”
。
3D科学谷曾在《重磅 !又一国产3D打印骨科植入物通过国家药监局审批》一文中对以上两款3D打印髋臼杯产品所使用的质料、技术的进行了剖析
。
为规范3D打印髋臼杯产品的注册申报和技术审评,提高技术审评事情效率,统一审评标准,国家药品监督治理局医疗器械技术审评中心组织起草了《3D打印髋臼杯产品注册技术审查指导原则》,并在9月4日宣布了指导原则的征求意见稿
。
3D打印髋臼杯工业化已至
指导原则适用于人工髋枢纽置换用假体组件–3D打印髋臼外杯,通常接纳TC4或TC4 ELI钛合金粉末激光或者电子束熔融等增材制造工艺生产,但不包括对定制式髋臼外杯及缺损垫块产品的要求
。
接下来,指导原则对3D打印髋臼外杯植入物的”技术审查要点”做了详细描述
。

3D打印髋臼杯技术审查要点
并在“产品研发要求”中对3D打印原质料、植入物中的多孔结构,增材制造植入物的化学身分、力学性能,植入物金属离子析出,植入物产品的机械性能、生物相容性等方面进行了详细描述
。
3D打印髋臼杯技术审查要点
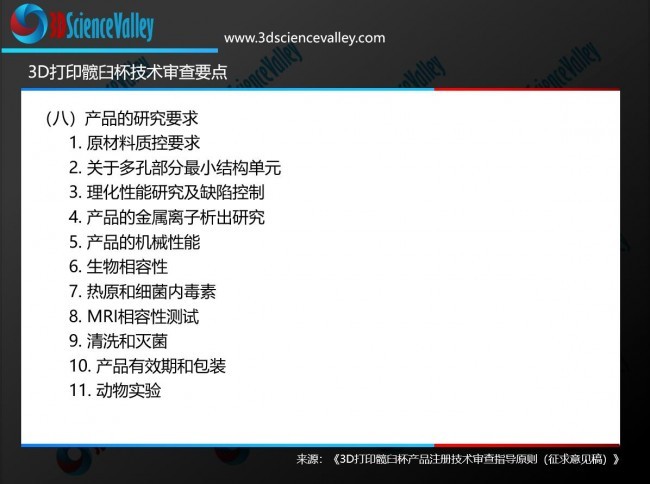
产品的研究要求
在打印原质料质控要求中,指导原则指出,企业关于合金粉末质料应该提供详细的材质单,包括粉末身分、粒度、粒径漫衍、球形度、松装密度、振实密度、流动性等,并应明确其所切合的标准
。若原质料外购,需明确原质料供应商并附其资质证明文件、供销关系证明文件(供销协议)、质量标准及验证报告
。并且应对粉末可接纳次数、筛分要领、新旧粉末混淆比例(如适合)等进行划定,并提供粉末接纳情况对打印历程和产品相关性能影响的验证资料
。
实现庞大、可控的多孔结构是粉末床金属熔化3D打印技术在植入物制造领域得以应用的优势之一,指导原则关于3D打印髋臼杯多孔部分也做了相应描述
。指导原则指出,企业应提供产品打印最小结构单位的选择和设定依据,如孔单位形态、孔径巨细及其漫衍、丝径、孔隙率、平均孔隙截距、孔隙梯度、内部连通性、多孔结构的厚度等的质控规模和确定依据
。
别的,由于增材制造历程中,粉体经逐层堆叠、高能束加热、快速凝固等历程,如工艺参数及后处理不当,产品较塑形加工材保存组织不均匀性及剩余应力等倒运因素,可能引起产品的耐腐化性能下降,加之多孔结构外貌积的增大,可能导致析出的合金元素离子浓度增高,指导原则关于金属3D打印髋臼杯的金属离子析出剖析给出了指导
。
指导原则建议针对产品的耐腐化性能及离子析出行为进行研究,应明确引用的标准、试验要领、试验介质、温度等,并对其可接受性进行论证,应考量外貌积巨细、孔隙率、打印偏向、位置、新旧粉末混淆等因素对结果的影响,选取最差情况进行试验
。

3D打印髋臼杯技术审查要点
产品生产制造相关要求
在3D打印髋臼杯的生产制造方面,指导原则关于增材制造软件、设备和质料都提出了相应审批指导建议,例如:
1、建议植入物制造企业论证患者影像数据收罗、处理、传输、三维建模、性能预测(如力学剖析)相关软件的兼容性、容错及可重复性、数据正确性和完整性,确保实现预期性能,明确所使用软件名称和版本号
。当软件需要更新及升级时,也必须进行再次确认
。
2、建议植入物制造企业建立完善的设备宁静确认、操作确认、性能确认等制度,确保切合要求的设备在及格的情况中被正确的使用
。
3、建议植入物制造企业明确原质料和加工助剂的信息,包括质料或化学信息以及质料参数和包括测试要领的质料剖析证书,建立对其原质料化学身分的检验要领
。
国家药品监督治理局医疗器械技术审评中心已开始针对《3D打印髋臼杯产品注册技术审查指导原则》,向相关领域的专家、学者、治理者及从业人员征求意见或建议,从而推动指导原则的富厚和完善
。意见或建议可通过反响意见表,以电子邮件的形式,于2019年10月7日前反响至国家药品监督治理局医疗器械技术审评中心
。
《3D打印髋臼杯产品注册技术审查指导原则(征求意见稿)》与反响意见表,可通过3D科学谷3D打印工业QQ链群(群号529965687)下载;
国家药品监督治理局医疗器械技术审评中心反响邮箱:handan@cmde.org.cn,donglh@cmde.org.cn
3D打印,医疗3D打印



